
7.1.6. Определение содержания хлорида натрия
Содержание хлорида натрия NaCl определяют титрованием пробы 0,1 н. раствором нитрата серебра или 0,1 н. раствором нитрата ртути (I) или нитрата ртути (II). Титрование нитратом серебра проводят при рН = 7 - 10, нитратом ртути - в азотнокислой среде. Определению мешают сульфиды и сульфиты.
Определение содержания хлорида натрия в отсутствие сульфидов и сульфитов. При проведении определения с применением нитрата серебра 10 мл профильтрованной или отстоявшейся отмочной жидкости помещают в коническую колбу вместимостью 100 или 250 мл, прибавляют 1 - 2 капли насыщенного раствора хромата калия К2СrО4 и медленно титруют 0,1 н. раствором нитрата серебра, хорошо перемешивая жидкость в колбе после добавления каждой капли. В точке эквивалентности происходит резкий переход желтой окраски в красновато-коричневую.
Ход реакции:,
NaCl + AgNО3 = NaNО3 + AgCl ↓.
При проведении определения с применением нитрата ртути (I) 10 мл профильтрованной или отстоявшейся отмочной жидкости помещают в коническую колбу вместимостью 100 или 250 мл, прибавляют 5 мл разбавленной (1:10) азотной кислоты, 3 - 4 капли 1%-ного раствора дифенилкарбазона и титруют 0,1 н. раствором нитрата ртути (I). Титрование заканчивают при переходе голубой окраски в сине-фиолетовую.
Чтобы голубая окраска не мешала фиксировать точку эквивалентности, при повторном титровании индикатор вносят в раствор перед окончанием титрования, не дотитровывая примерно 0,5 мл. Чем позже будет прибавлен индикатор, тем резче переход окраски.
Ход реакции:
2NaCl + Hg2(NО3)2 = 2NaNО3 + Hg2Cl2.
Содержание хлорида натрия, г/л,
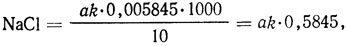
где а - объем 0,1 н. раствора нитрата серебра или нитрата ртути (I),. израсходованный на титрование, мл; k - поправочный коэффициент для приведения концентрации раствора нитрата серебра или нитрата ртути (I) к точно 0,1 н.; 0,005845 - количество хлорида натрия, соответствующее 1 мл 0,1 н. раствора нитрата серебра или нитрата ртути (I), г.
Определение хлорида натрия в присутствии сульфидов и сульфитов. 25 мл профильтрованной или отстоявшейся отмочной жидкости переносят в термостойкую коническую колбу вместимостью 250 мл, приливают 10 мл концентрированной азотной кислоты и кипятят 12 - 15 мин. При этом сульфиды и сульфиты окисляются до сульфатов. Гидролизат охлаждают и переносят в мерную колбу вместимостью 250 мл, доводят объем раствора до метки дистиллированной водой, перемешивают.
Качественно устанавливают отсутствие сульфидов или сульфитов: в пробирку наливают 1 - 2 мл гидролизата и прибавляют 2 - 3 капли раствора нитрата ртути (I). Если появляется темный осадок, значит окисление сульфидов или сульфитов не закончилось и следует повторить их окисление с новой порцией отмочной жидкости, увеличив продолжительность кипячения.
При отрицательной реакции на сульфиды и сульфиты отбирают из мерной колбы для анализа 25 мл гидролизата, переносят в коническую колбу вместимостью 250 мл, приливают 50 мл дистиллированной воды, добавляют 5 - 6 капель дифенилкарбазона и титруют раствором нитрата ртути (I), как описано выше.
Содержание хлорида натрия, г/л,
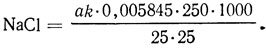
Определение хлорида натрия в прозрачном гидролизате можно провести с использованием 0,1 н. раствора нитрата ртути (II) в присутствии нитропруссида натрия. Из мерной колбы 25 мл гидролизата переносят в коническую колбу вместимостью 250 мл, приливают 75 мл дистиллированной воды и 1 мл 10 %-ного раствора нитропруссида натрия. Титруют 0,1 н. раствором нитрата ртути (II) до появления неисчезающей мути от образования нитропруссида ртути. Титрование лучше вести на темном фоне.
Ход реакции:
2NaCl + Hg(NО3)2 = 2NaNО3 + HgCl2 ↓
Содержание хлорида натрия определяют по формуле, приведенной выше.
© FURLIB.RU, 2013-2018
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"