
7.2.1. Определение содержания гидроксида кальция и сульфида натрия в зольной жидкости
В жидкости, содержащей гидроксид кальция Са(ОН)2 и сульфид натрия Na2S, при титровании кислотой в присутствии фенолфталеина определяется все количество гидроксида кальция и половина количества сульфида натрия; последний в воде гидролизуется на гидросульфид натрия и гидроксид натрия. Поэтому определяют сначала содержание сульфида натрия: 10 мл исследуемого раствора + 50 мл прокипяченной дистиллированной воды + 10 мл 0,1 н. раствора гидроксида натрия + 1 мл 0,4%-ного раствора нитропруссида натрия (в качестве индикатора) титруют 0,1 н. раствором гексацианферрата калия до перехода фиолетовой окраски в светло-желтую.
Содержание сульфида натрия, г/л,
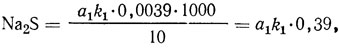
где a1 - объем 0,1 н. раствора гексацианферрата калия, израсходованный на титрование, мл; k1 - поправочный коэффициент для приведения концентрации гексацианферрата калия к точно 0,1 н. раствору.
10 мл хорошо перемешанной зольной жидкости переносят пипеткой в коническую колбу и медленно при тщательном перемешивании титруют в присутствии 1 - 2 капель фенолфталеина 0,5 н. раствором соляной кислоты до обесцвечивания. Окраска не должна появляться в течение 3 мин.
Ход реакции:
Са(ОН)2 + 2НCl = СаCl2 + 2Н2О;
Na2S + НCl = NaHS + NaCl.
В жидкости без сульфида натрия содержание оксида или гидроксида кальция вычисляют по формулам, г/л,
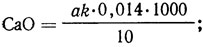
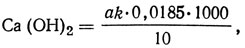
где a - объем соляной кислоты, израсходованный на титрование, мл; k - поправочный коэффициент для приведения концентрации раствора соляной кислоты к точно 0,5 н.; 0,014 - количество оксида кальция, соответствующее 1 мл 0,5 н. раствора соляной кислоты, г; 0,0185 - количество гидроксида кальция, соответствующее 1 мл 0,5 н. раствора соляной кислоты, г.
В присутствии сульфида натрия вычисленное таким образом содержание оксида или гидроксида кальция должно быть уменьшено в связи с тем, что при титровании кислотой (индикатор фенолфталеин) определяют не только все количество оксида или гидроксида кальция, но и половину количества сульфидов. Поэтому при определении содержания оксида и гидроксида кальция в присутствии сульфида натрия надо из общего количества соединений кальция в жидкости вычесть половину содержащегося в ней сульфида натрия, выраженного в эквивалентном количестве соединений кальция:
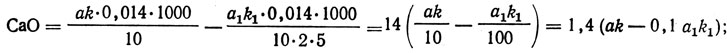
где a - объем соляной кислоты, израсходованный на титрование, мл; k - поправочный коэффициент для приведения концентрации раствора соляной кислоты к точно 0,5 н.; а1 - объем гексацианферрата калия, израсходованный на титрование, мл; k1 - поправочный коэффициент для приведения концентрации раствора гексацианферрата калия к точно 0,1 н.
При малом содержании сульфида натрия в зольной (или отмочной) жидкости увеличивают ее объем для титрования до 25 мл, а для определения оксида или гидроксида кальция оставляют 10 мл.
Пример. На титрование 25 мл зольной жидкости израсходовано 6,2 мл 0,1 н. раствора гексацианферрата калия; на титрование 10 мл той же жидкости израсходовано 10,9 мл 0,5 н. раствора соляной кислоты. Следовательно, содержание оксида кальция в зольной жидкости, г/л (при условии, что k = k1 = 1,0),
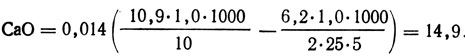
Если в зольной жидкости нужно определить только общую щелочность (содержание всех щелочей и сульфидов), нет необходимости проводить два титрования - кислотой и гексацианферратом калия. Обычно общую щелочность определяют титрованием 0,5 н. раствором соляной кислоты в присутствии 1 - 2 капель индикатора метилового оранжевого.
Содержание общей щелочности в пересчете на тидроксид натрия, г/л,
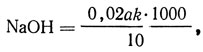
где а - объем соляной кислоты, израсходованный на титрование, мл; k - поправочный коэффициент для приведения концентрации раствора соляной кислоты к точно 0,5 н.; 0,02 - количество гидроксида натрия, соответствующее 1 мл 0,5 н. раствора соляной кислоты, г.
© FURLIB.RU, 2013-2018
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"