
7.3.2. Определение содержания оксида кальция в голье
Содержание оксида кальция в голье может быть определено весовым или объемным методом.
Весовой метод. Навески голья по 3 г разлагают в 30 - 40 мл концентрированной азотной кислоты при нагревании на электроплитке или на горелке в течение 30 - 40 мин. Затем нейтрализуют раствором аммиака до появления слабого запаха и добавляют несколько миллилитров 10%-ной соляной кислоты до исчезновения запаха аммиака. В нагретый до кипения раствор добавляют 2 - 3 г сегнетовой соли C4H4O6KNa.4H2O, предварительно растворенной горячей водой в пробирке, затем 1 г щавелевой кислоты H2C2O4.2H2O, растворенной в 10 мл горячей воды. Перемешав раствор стеклянной палочкой, начинают вливать в него (при помешивании) порциями горячий разбавленный (1:1) раствор аммиака. Аммиак необходим для нейтрализации соляной кислоты, имеющейся в растворе и образующейся в результате реакции, так как оксалат кальция не выпадает в осадок в присутствии минеральной кислоты. Чтобы установить окончание нейтрализации кислоты, в раствор перед приливанием раствора аммиака добавляют 3 - 4 капли индикатора метилового оранжевого или метилового красного. Раствор аммиака приливают до перехода розовой окраски раствора в желтую. После этого приливают еще около 5 мл раствора аммиака до появления запаха.
Ход реакций:
СаCl2 + Н2С2О4 + Н2О = СаС2О4·Н2О ↓ + 2НCl
НCl + NH4OH = NH4Cl + Н2O
Для вызревания осадка (образования более крупных кристаллов) стакан с осадком помещают в кипящую водяную баню на 30 мин. Затем осадок отфильтровывают через двойной крупнопористый фильтр. Перед фильтрованием фильтр помещают в воронку и хорошо прогревают горячей дистиллированной водой. Затем на фильтр по стеклянной палочке сливают жидкость из стакана, а когда она профильтруется, переносят на фильтр осадок, смывая его со дна и стенок стакана горячим 1%-ным раствором оксалата аммония (NH4)2C2О4·2H2О.
Осадок на фильтре промывают 4 раза горячим раствором оксалата аммония, а не дистиллированной водой, чтобы понизить растворимость оксалата кальция при промывке. При последующем озолении оксалат аммония разлагается:
(NH4)2C2О4 · 2H2O = 2NH3 + 2Н2О + СО + СО2
Струю промывной жидкости направляют на край фильтра, наполняют жидкостью весь фильтр и ждут, пока вся жидкость стечет.
К концу промывания, осторожно действуя промывной жидкостью, осадок собирают в устье воронки. Нельзя оставлять осадок непромытым на фильтре на ночь и заканчивать промывание на следующий день.
Промытый осадок оксалата кальция озоляют. Так как оксид кальция не восстанавливается углем фильтра, осадок можно прокаливать вместе с фильтром, даже предварительно не высушивая. Для этого влажный фильтр с осадком помещают в платиновый тигель и нагревают сначала очень осторожно, пока не обуглится бумага и не прекратится выделение газов.
Нагревание продолжают при доступе воздуха, пока не выгорит весь уголь, и заканчивают при температуре около 900°С.
Ход реакции при прокаливании:
СаС2О4 · Н2О = СаСО3 + СО + Н2О;
CaCО3 → CaO + СО2.
Охладив прикрытый крышкой тигель в эксикаторе, взвешивают и прокаливают еще раз в течение 5 мин. После охлаждения тигель вновь сразу взвешивают, так как оксид кальция поглощает из воздуха влагу и оксид углерода.
Содержание оксида кальция, %,
СаО = 100 m/н,
где m - масса прокаленного осадка, г; н - навеска голья, г.
Растворимость оксалата кальция при температуре 18°С 0,00642 г/л или в пересчете на оксид кальция 0,0025 г/л.
Если условия опыта позволяют пренебречь растворимостью оксалата кальция в чистой воде при промывании его на фильтре, то весовой метод определения содержания оксида кальция можно заменить объемным.
Объемный метод. Осадок оксалата кальция на воронке промывают 4 - 5 раз холодной водой. Воронку с промытым осадком ставят наклонно над стаканом или конической колбой и тонкой струей воды из промывалки смывают осадок с фильтра. Ставят воронку в обычное положение и пропускают через фильтр (наполняя его 2 - 3 раза) горячую 20%-ную серную кислоту для растворения оставшегося на фильтре осадка, собирая стекающую жидкость в тот же сосуд, где находится основная масса осадка.
В сосуде с фильтратом должно быть 250 - 300 мл раствора. Раствор нагревают до температуры 70 - 80°С и титруют образовавшуюся щавелевую кислоту 0,1 н. раствором перманганата калия КМnО4 до появления неисчезающего розового окрашивания. Розовая окраска раствора особенно отчетливо заметна, если под стакан (или колбу) подложить лист белой бумаги; нагревание до кипения перед титрованием не рекомендуется, так как это может вызвать образование осадка.
Ход реакции:
СаС2О4 + H2SО4 = CaSО4 + C2H2О4;
2КМnО4 + 5С2Н2О4 + 3H2SО4 = K2SО4 + 2MnSО4 + 8Н2О + 10СО2.
Содержание оксида кальция, %,
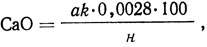
где а - объем 0,1 н. раствора перманганата калия, пошедший на титрование, мл; k - поправочный коэффициент к титру 0,1 н. раствора перманганата калия; 0,0028 - количество оксида кальция, соответствующее 1 мл 0,1 н. раствора перманганата калия, г; н - навеска голья, г.
Объемный комплексонометрический метод. 3 - 3,5 г голья взвешивают с погрешностью не более 0,0002 г и помещают в термостойкую коническую колбу вместимостью 500 мл. В колбу приливают 140 мл дистиллированной воды и 10 мл 30%-ного раствора гидроксида натрия. Колбу помещают на плитку с закрытой спиралью и нагревают с обратным холодильником.
Гидролиз голья проходит в течение 10 - 15 мин с момента закипания жидкости.
После полного растворения голья раствор охлаждают и переносят в мерную колбу вместимостью 500 мл. Коническую колбу ополаскивают сначала небольшим количеством соляной кислоты для удаления остатков извести на стенках колбы и сливают в мерную колбу, а затем несколько раз дистиллированной водой и также сливают в мерную колбу. Содержимое мерной колбы доводят до метки дистиллированной водой и перемешивают.
Проверяют рН разбавленного гидролизата по индикаторной бумаге. Если рН гидролизата больше или меньше 10, его доводят до 10 добавлением 0,1 н. раствора соляной кислоты или 0,1 н. раствора гидроксида натрия.
Для этого пипеткой отбирают 10 мл гидролизата и переносят в коническую колбу вместимостью 250 мл, прибавляют 1 - 2 капли 1%-ного раствора фенолфталеина. Если окраски нет, титруют раствором щелочи до появления розовой окраски. Отмечают объем израсходованной щелочи.
Если рН выше 10, гидролизат титруют 0,1 н. раствором соляной кислоты до исчезновения окраски от 1 капли кислоты, отмечают объем кислоты. Затем прибавляют раствор 0,1 н. гидроксида натрия до появления розовой окраски и также отмечают объем щелочи.
В колбу для титрования помещают 10 мл гидролизата, приливают раствор кислоты или щелочи, необходимой для доведения рН среды до 10, прибавляют 15 мл аммиачного буферного раствора и 3 - 4 капли раствора индикатора кислотного хрома темно-синего. Раствор перемешивают и титруют 0,0054 М раствором трилона Б до перехода красной окраски жидкости в синюю. Ход реакции показан выше при определении содержания гидроксида кальция в зольной жидкости.
Содержание оксида кальция, %,
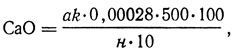
где а - объем 0,005 М раствора трилона Б, пошедший на титрование, мл; k - поправочный коэффициент для приведения концентрации раствора трилона Б к точно 0,005 М; 0,00028 - количество оксида кальция, соответствующее 1 мл 0,005 М раствора трилона Б, г; н - навеска голья, г.
Приготовление аммиачного буферного раствора: 54 г хлорида аммония растворяют в 200 мл дистиллированной воды. К полученному раствору приливают 350 мл 25%-ного раствора гидроксида аммония. Раствор переносят в мерную колбу вместимостью 1 л и доводят объем до метки дистиллированной водой.
Приготовление 0,005М раствора трилона Б ведут так же, как для анализа зольной жидкости, содержащей гидроксид кальция, сульфид и гидросульфид натрия. Однако количество трилона Б уменьшается в 10 раз, так как при анализе зольной жидкости применяется не 0,005 М, а 0,05 М раствор трилона Б (см. выше).
© FURLIB.RU, 2013-2018
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"