
7.6. Анализ минеральных дубителей и дубильных жидкостей
7.6.1. Анализ жидкого хромового дубителя и дубильных жидкостей
Приготовление аналитического раствора. Сначала с помощью ареометра определяют плотность раствора испытуемого жидкого хромового дубителя или дубильной жидкости, затем в соответствии с приведенной таблицей производят разведение в зависимости от их исходной плотности для получения аналитического раствора.
Разведение жидких хромовых дубителей и дубильных жидкостей для приготовления аналитического раствора и расчет содержания оксида хрома
| Плотность испытуемого жидкого хромового дубителя или дубильной жидкости (по ареометру при температуре 20 ± 2°С), г/см3 | Объем испытуемого жидкого хромового дубителя или дубильной жидкости, мл | Вместимость мерной колбы, мл | Коэффициент пересчета точно 0,1 н. раствора тиосульфата натрия, израсходованного на титрование, на содержание Сr2О3, г/л |
| До 1,384 | 10 | 500 | 25,33 |
| 1,383 - 1,263 | 20 | 500 | 12,666 |
| 1,262 - 1,163 | 20 | 250 | 6,333 |
| 1,162 - 1,075 | 50 | 250 | 2,533 |
| Менее 1,075 | 5* | - | 0,507 |
*(Берется неразбавленный фильтрованный испытуемый раствор.)
При анализе сухого хромового дубителя готовят аналитический раствор, содержащий 20 г дубителя в 1 л.
Определение содержания невосстановленного хрома. Качественная проба на невосстановленный дихромат выполняется следующим образом. К 1 - 2 мл 3%-ного раствора пероксида водорода приливают немного разбавленной серной кислоты (2 г воды и 1 г серной кислоты плотностью 1,84 г/см) и около 2 мл серного эфира. Смесь осторожно взбалтывают, прибавляют 1 - 2 мл испытуемого хромового дубителя и снова немедленно взбалтывают. В присутствии 0,1 мг хромовой кислоты всплывший вверх эфирный слой окрашивается в интенсивно-синий цвет (это вызывается образованием надхромовых кислот, растворимых в эфире). Синее окрашивание эфира заметно даже в присутствии 0,007 мг хромовой кислоты.
Если проба на невосстановленный дихромат дает положительный результат, производят количественное определение невосстановленного хрома в пересчете на СrО3 следующим образом: определяют плотность анализируемого раствора хромового дубителя при комнатной температуре; по таблице выше производят его разведение в зависимости от плотности для получения аналитического раствора.
В коническую колбу вместимостью 500 мл вносят пипеткой 20 - 50 мл аналитического раствора хромового дубителя, добавляют до 300 мл дистиллированной воды, 5 мл 20%-ного раствора серной кислоты и 10 мл 10%-ного раствора йодида калия. Колбу закрывают часовым стеклом, оставляют в темном месте на 5 мин и затем титруют выделившийся йод 0,1 н. раствором тиосульфата натрия Na2S203 в присутствии крахмала до исчезновения синего окрашивания раствора.
Ход реакций:
К2Сr2О7 + 6KI + 7H2SО4 = 4K2SО4 + Cr2(SО4)3 + 7Н2О + 3I2;
I2 + 2Na2S2О3 = 2NaI + Na2S4О6.
Содержание оксида хрома (VI), г/л,
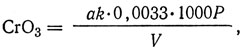
где а - объем 0,1 н. раствора тиосульфата, израсходованный при титровании, мл; V- объем аналитического раствора хромового дубителя, взятый для определения оксида хрома (VI), мл; k - поправочный коэффициент к титру 0,1 н. раствора тиосульфата натрия; Р - коэффициент разбавления хромового дубителя при приготовлении аналитического раствора; 0,0033 - количество оксида хрома (VI), соответствующее 1 мл 0,1 и. раствора тиосульфата натрия, г.
Определение содержания оксида хрома. Для определения содержания оксида хрома титрованием хром (III) окисляют до хрома (VI), используя для этой цели пероксиды, персульфат аммония или хлорную кислоту.
При окислении хрома (III) пероксидами отбирают пипеткой 5 мл аналитического раствора и переносят в коническую колбу вместимостью 150 - 250 мл. В колбу добавляют 5 мл дистиллированной воды и 1,5 г пероксида натрия.
Вместо пероксида натрия окисление хрома можно вести пероксидом водорода. В этом случае к аналитическому раствору, не прибавляя воды, приливают 1 н. раствор гидроксида натрия до растворения появившегося осадка и 5 мл 3%-ного раствора пероксида водорода. Далее в обоих случаях, прикрыв колбу воронкой, смесь слегка взбалтывают и кипятят на электроплитке или газовой горелке (с асбестовой сеткой) в течение 3 мин. Затем добавляют 5 мл 5%-ного раствора сульфата никеля и кипятят еще 3 мин. После охлаждения к содержимому колбы приливают 20%-ный раствор серной кислоты до полного растворения выпавшего осадка гидроксида никеля; добавляют еще 5 мл 20%-ного раствора серной кислоты и 5 мл 10%-ного раствора йодида калия. Стенки колбы ополаскивают из промывалки дистиллированной водой, закрывают колбу стеклом и оставляют в темном месте на 5 мин, затем титруют ее содержимое 0,1 н. раствором тиосульфата натрия в присутствии крахмала до исчезновения синего окрашивания.
Ход реакций:
Сr2 (SO4)n(OH)6-2n + Н2O2 + NaOH → Na2CrO4 + Na2SО4 + Н2O;
2Na2CrО4 + 6KI + 8H2SО4 = Cr2(SО4)3 + 3I2 + 2Na2SО4 + 3K2SО4 + 8H2O;
I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Содержание оксида хрома (III), г/л,
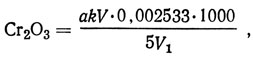
где a - объем 0,1 н. раствора тиосульфата натрия, израсходованный при титровании, мл; k - поправка к титру 0,1 н. раствора тиосульфата натрия; 0,002533 - количество оксида хрома, соответствующее 1 мл 0,1 н. раствора тиосульфата натрия, г; V - общий объем аналитического раствора (объем мерной колбы, в которой производится разбавление), мл; V1 - объем жидкого хромового дубителя (или дубильной жидкости), взятый для разбавления, мл.
Содержание оксида хрома можно вычислить умножением числа миллилитров точно 0,1 н. раствора тиосульфата, израсходованного при титровании, на соответствующий коэффициент, указанный в таблице выше (при данном разведении).
При окислении хрома (III) персульфатом аммония 5 мл аналитического раствора помещают в термостойкую коническую колбу вместимостью 500 мл, приливают 200 мл дистиллированной воды, 10 мл раствора серной кислоты (1:1) и нагревают до кипения. Прибавляют 7 г персульфата аммония, обмывают стенки колбы водой, перемешивают раствор и кипятят в течение 30 - 35 мин. После охлаждения к раствору приливают 30 мл раствора серной кислоты (1:1), 5 мл ортофосфорной кислоты и охлаждают смесь до комнатной температуры. Титруют 0,1 н. раствором соли Мора в присутствии 10 капель раствора N-фенилантраниловой кислоты (индикатор) до перехода фиолетово-вишневой окраски в зеленую.
Ход реакций:
Сr2(SO4)n(OH)6-2n + (NH4)2S2O8 + H2O → (NH4)2Cr2O7 + (NH4)2SО4 + H2SО4;
(NH4)2Cr2O + 6(NH4)2Fe(SО4)2 + 7H2SО4 = Cr2(SО4)3 + 3Fe2(SО4)3 + 7(NH4)2SО4 + 7H2O.
Содержание оксида хрома (III), г/л,
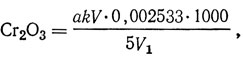
где а - объем раствора соли Мора, израсходованный на титрование, мл; k - поправочный коэффициент для приведения концентрации раствора соли Мора к точно 0,1 н.; V - общий объем аналитического раствора, мл; V1 - объем жидкого хромового дубителя (или дубильной жидкости), взятый для разбавления, мл; 0,002533 - количество оксида хрома (III), соответствующее 1 мл 0,1 н. раствора соли Мора, г.
Раствор N-фенилантраниловой кислоты готовят растворением 0,2 г препарата в 100 мл 0,2%-ного раствора карбоната натрия.
0,1 н. раствор соли Мора готовят следующим образом. Около 40 г голубовато-зеленых (без бурого оттенка) кристаллов соли Мора (х. ч.) растворяют в 500 мл дистиллированной воды. К раствору осторожно приливают 100 мл концентрированной серной кислоты. Раствор охлаждают и разбавляют водой до 1 л. В случае необходимости (если раствор мутный) раствор фильтруют. Раствор следует хранить в темной склянке.
Поправку к титру раствора соли Мора устанавливают по 0,1 н. раствору дихромата калия К2Сr2О7, который готовят из фиксанала.
25 мл 0,1 н. раствора дихромата калия помещают в коническую колбу вместимостью 500 мл, добавляют 150 мл воды, 40 мл раствора серной кислоты (1:1), 5 мл ортофосфорной кислоты и титруют раствором соли Мора в присутствии 10 капель N-фенилантраниловой кислоты до перехода фиолетово-вишневой окраски в зеленую.
Поправочный коэффициент к 0,1 н. раствору соли Мора рассчитывают по формуле
k = 25/b,
где b - объем 0,1 н. раствора соли Мора, израсходованный на титрование, мл; 25 - объем точно 0,1 н. раствора дихромата калия, взятый для титрования.
Поправочный коэффициент к титру раствора соли Мора определяют ежедневно.
При окислении хрома (III) хлорной кислотой 5 мл аналитического раствора помещают в термостойкую коническую колбу вместимостью 250 мл, приливают 8 мл концентрированной азотной кислоты, 12 мл концентрированной серной кислоты и 10 мл 42 - 53%-ной хлорной кислоты. Колбу помещают на плитку и кипятят до перехода окраски раствора из зеленой в оранжевую; после этого раствор продолжают еще кипятить 0,5 - 1,0 мин. Затем его охлаждают, приливают 80 - 100 мл дистиллированной воды и снова кипятят 5 - 7 мин.
После охлаждения к раствору приливают 15 мл 10%-ного раствора йодида калия, закрывают часовым стеклом и помещают в темное место на 5 мин. Выделившийся йод титруют 0,1 н. раствором тиосульфата натрия, добавляя в конце титрования крахмал. Титрование заканчивают при исчезновении синего окрашивания.
Параллельно проводят глухой опыт.
Ход реакций:
Cr2(SО4)n(ОН)6-2n + НClО4 + Н2О → Н2Сr2О7 + НCl + H2SO4;
H2Cr2О7 + 6KI + 6H2SО4 = 3K2SО4 + Cr2(SО4)3 + 3I2 + 7H2О;
I2 + 2Na2S2О3 = 2NaI + Na2S4О6.
Содержание оксида хрома (III), г/л,
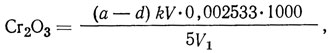
где a - объем тиосульфата натрия, израсходованный на титрование, мл; d - объем тиосульфата натрия, израсходованный на титрование в глухом опыте, мл; k - поправочный коэффициент для приведения концентрации раствора тиосульфата натрия к точно 0,1 н.; V - объем аналитического раствора (объем мерной колбы, в которой производили разбавление), мл; V1 - объем раствора дубителя, взятый для разбавления, мл; 0,002533 - количество оксида хрома (III), соответствующее 1 мл 0,1 н. раствора тиосульфата натрия, г.
Этот метод может применяться для определения содержания оксида хрома (III) в присутствии органических дубителей.
При выполнении анализа хлорную кислоту следует приливать только после серной кислоты.
Фотоколориметрическое определение содержания оксида хрома в растворе. Метод основан на получении окрашенного раствора триоксалатохромового комплекса при взаимодействии основного сульфата хрома со щавелевой кислотой:
Сr(ОН)SО4 + 3Н2С2О4 = [Сr(С2О4)3]Н3 + Н2О + H2SО4.
4,903 г химически чистого дихромата калия или 4,367 г дихромата натрия (лучше брать фиксанал 0,1 н. раствора дихромата калия) растворяют в мерной колбе вместимостью 1000 мл. Приготовленный раствор содержит 2,53 г/л оксида хрома. Готовят серию эталонных растворов из расчета содержания оксида хрома 0,07 - 0,5 г/л.
В колбы вместимостью 100 мл наливают из калиброванной бюретки 3, 5, 7, 10, 12, 15, 17, 20 мл приготовленного раствора дихромата калия. В каждую колбу добавляют по 25 мл 5%-ного раствора щавелевой кислоты и кипятят 3 - 5 мин. Полученные фиолетовые растворы охлаждают, переносят в мерные колбы вместимостью 100 мл, доводят до метки дистиллированной водой, тщательно перемешивают и фотоколориметрируют с применением светофильтра с длиной волны 560 - 580 нм.
Содержание оксида хрома в эталонных растворах, г/л: 0,076; 0,126; 0,177; 0,253; 0,304; 0,379; 0,430; 0,506.
Зная показания фотоколориметра и содержание оксида хрома, строят калибровочный график. На оси ординат откладывают показания фотоколориметра, на оси абсцисс - соответствующие концентрации три- оксалатохромового комплекса в пересчете на оксид хрома в граммах на литр. Периодически кривую проверяют по 3 - 4 точкам.
Для анализа производственных жидкостей приготовленный хромовый дубитель охлаждают до температуры 20°С, отбирают пипеткой 10 мл (пипетка должна быть откалибрована на наполнение) и переносят в мерную колбу вместимостью 500 мл. Пипетку ополаскивают водой в мерную колбу. Объем раствора в колбе доводят до метки водой.
Для анализа начальной дубильной жидкости пипеткой отбирают 50 мл, переносят в мерную колбу вместимостью 100 мл и доливают воду до метки. Отработанный раствор хромового дубителя не разбавляют.
Далее для каждого из приведенных случаев в колбу вместимостью 100 - 150 мл вносят 10 мл профильтрованного аналитического раствора из мерной колбы, 25 мл 5%-ного раствора щавелевой кислоты и кипятят 3 - 5 мин. После охлаждения раствор количественно переносят в мерную колбу вместимостью 100 мл, доводят до метки дистиллированной водой, тщательно перемешивают и фотоколориметрируют.
Если во время кипячения в отработанном растворе хромовой соли появилась муть, раствор снова фильтруют. Содержание оксида хрома (III) в жидком хромовом дубителе, г/л,
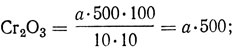
содержание оксида хрома (III) в начальной дубильной жидкости, г/л,
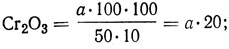
содержание оксида хрома (III) в отработанных дубильных жидкостях, г/л,
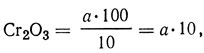
где а - количество оксида хрома (III), найденное по калибровочному графику, г/л.
Определение содержания оксида хрома в дубильных жидкостях с помощью эталон-пробирок. Этот метод можно применять в тех случаях, когда не требуется особой точности или необходимо быстро получить результаты (дубильная жидкость в процессе дубления, отработанная жидкость после хромового дубления).
Берут 19 одинаковых пробирок диаметром около 8 мм из стекла одного цвета (эталон-пробирки). Пробирки устанавливают в один ряд в штативах таким образом, чтобы между ними оставались свободные гнезда для помещения пробирок с испытуемым раствором хромового дубителя. Затем эталон-пробирки наполняют стандартными растворами оксалатохромовой соли следующих концентраций в пересчете на оксид хрома, г/л: 1,0; 1,2; 1,4; 1,6; 1,8; 2,0; 2,2; 2,4; 2,6; 2,9; 3,2; 3,5; 3,9; 4,3; 4,7; 5,2; 5,7; 6,3; 7,0.
Пробирки закрывают резиновыми или корковыми пробками и заливают пробки парафином. Исходный стандартный раствор оксалато-хромкомплекса (III), содержащий 7 г/л Сг2О3, готовят следующим образом.
Навеску 13,546 г химически чистого дихромата калия растворяют в 100 мл (приблизительно) горячей дистиллированной воды, налитой в стакан вместимостью 1 л. Стакан закрывают часовым стеклом и в него при нагревании осторожно и постепенно приливают 60 мл 10%-ного раствора щавелевой кислоты.
Восстановление хрома (VI) в хром (III) должно быть полным (проба на полноту восстановления). Полученный раствор количественно переводят в колбу вместимостью 1 л, охлаждают и доливают до метки дистиллированной водой.
Из исходного стандартного раствора приготовляют посредством разведения 1 н. раствором щавелевой кислоты растворы оксалатохромовой соли указанных выше концентраций в пересчете на оксид хрома (III).
Для этого с помощью двух бюреток вливают в стаканчики указанные ниже количества исходного стандартного раствора и 1 н. раствора щавелевой кислоты (63,02 г/л C2H2O4.2H2O).
Полученные растворы переливают в пробирки диаметром 8 мм и закрывают, как указано выше.
Количество стандартного раствора и щавелевой кислоты для приготовления растворов с различным содержанием оксида хрома (III)
| Содержание Сr2О3, г/л | Объем исходного стандартного раствора, мл | Объем 1 н. раствора щавелевой кислоты, мл |
| 1,0 | 3,6 | 21,4 |
| 1,2 | 4,3 | 20,7 |
| 1,4 | 5,0 | 20,0 |
| 1,6 | 5,7 | 19,3 |
| 1,8 | 6,4 | 18,6 |
| 2,0 | 7,1 | 17,9 |
| 2,2 | 7,9 | 17,1 |
| 2,4 | 8,6 | 16,4 |
| 2,6 | 9,3 | 15,7 |
| 2,9 | 10,4 | 14,6 |
| 3,2 | 11,4 | 13,6 |
| 3,5 | 12,5 | 12,5 |
| 3,9 | 13,9 | 11,1 |
| 4,3 | 15,3 | 9,7 |
| 4,7 | 16,8 | 8,2 |
| 5,2 | 18,6 | 6,4 |
| 5,7 | 20,4 | 4,6 |
| 6,3 | 22,5 | 2,5 |
| 7,0 | 25,0 | 0 |
Определение содержания оксида хрома (III) в дубильных жидкостях производят следующим образом. К 5 мл дубильной жидкости в пробирке, на которой нанесена метка 5 мл, прибавляют стеклянной ложечкой 0,15 - 0,20 г щавелевой кислоты. Для удобства работы ложечку выдувают из стеклянной трубки такого объема, чтобы, будучи заполненной до краев, она вмещала в себя 0,15 - 0,20 г мелких кристаллов щавелевой кислоты.
Содержимое пробирки нагревают до кипения и кипятят 2 мин, следя за временем кипения по песочным часам. Для нагревания удобно использовать воздушную баню.
После охлаждения до комнатной температуры в пробирку доливают дистиллированную воду взамен выкипевшей до отметки на пробирке и жидкость отфильтровывают от выделившегося оксалата кальция (соли кальция могут присутствовать в дубильной жидкости) в чистую пробирку, имеющую тот же диаметр, что и эталонные пробирки.
Содержание оксида хрома (III) находят путем визуального сравнения окраски раствора в пробирке с близкими по интенсивности окрашивания эталон-пробирками.
Экспресс-метод определения содержания оксида хрома (III) в дубильных жидкостях на приборе "Хром-КРМ". Это определение можно произвести на радиоизотопном концентратомере "Хром-КРМ" (рис. 2). В основу работы прибора положен метод рентгенофлуоресцентного анализа. Рентгеновское излучение от двух радиоактивных источников плутоний-238 возбуждает характеристическое излучение атомов хрома, которые находятся в анализируемом объекте. Интенсивность характеристического излучения пропорциональна содержанию хрома. Это излучение регистрируется электронно-измерительным устройством.
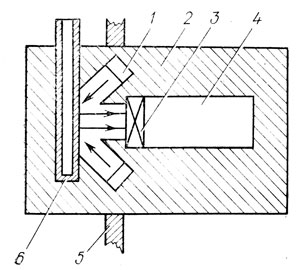
Рис. 2. Схема радиоизотопного узла прибора 'Хром-КРМ': 1 - источник излучения ИРИПЛ-3; 2 - корпус датчика; 3 - сцинтиляционный кристалл; 4 - электронно-измерительное устройство; 5 - передняя панель прибора; 6 - кювета с анализируемым раствором
Раствор дубителя заливают в кювету из органического стекла, вставляют в измерительный блок и включают измерительное устройство. Через 1,5 мин на цифровом табло высвечивается результат анализа - содержание оксида хрома (III) в граммах на литр.
Диапазон определяемых концентраций оксида хрома 1 - 35 г/л абсолютной погрешностью не более ±(0,5+0,05С) г/л, где С - определяемая концентрация оксида хрома (III).
Прибор "Хром-КРМ" может быть использован и для определения содержания оксида хрома (III) в коже до отделки.
Определение основности растворов дубящих соединений хрома. 10 мл аналитического раствора помещают в коническую колбу вместимостью 250 мл, приливают 50 мл дистиллированной воды, нагревают до кипения и титруют горячий раствор 0,1 н. раствором гидроксида натрия в присутствии 4 - 6 капель 1%-ного спиртового раствора фенолфталеина. Конец титрования определяют по появлению бледно-розового окрашивания жидкости над осадком.
Основность определяют по формуле, %,
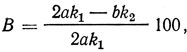
где а - объем 0,1 н. раствора тиосульфата натрия или соли Мора, израсходованный на определение содержания оксида хрома (III) в 5 мл раствора, мл; k1 - поправочный коэффициент к титру 0,1 н. раствора тиосульфата натрия или соли Мора; b - объем 0,1 н. раствора гидроксида натрия, израсходованный на титрование 10 мл аналитического раствора, мл; k2 - поправочный коэффициент к титру 0,1 н. раствора гидроксида натрия.
Сказанное относится и к отработанным дубильным жидкостям с плотностью 1,039 г/см3 и ниже, которые анализируются без разбавления.
При наличии в дубильной жидкости солей аммония вначале проводят качественное определение их содержания. Около 5 мл испытуемого хромового дубителя (разбавленного приблизительно в два раза) или дубильной жидкости нагревают в пробирке с 0,5 - 1 мл 20%-ной щелочи гидроксида калия или натрия. Если в растворе содержатся аммонийные соли, то при нагревании со щелочью они разлагаются с выделением аммиака, который может быть обнаружен по покраснению влажной oфенолфталеиновой бумажки или по посинению также влажной красной лакмусовой бумажки, помещенной над пробиркой.
После установления наличия аммонийных солей в испытуемом хромовом дубителе или дубильной жидкости определяют основность. 10 мл аналитического раствора помещают в коническую колбу вместимостью 250 мл, прибавляют около 50 мл дистиллированной воды, нагревают раствор до кипения и титруют 0,1 н. раствором щелочи с 4 - 6 каплями индикатора (раствор розоловой кислоты: 0,04 г розоловой кислоты, 40 мл спирта, 60 мл дистиллированной воды). Конец реакции определяют по слабо-розовому цвету раствора над осадком. Основность подсчитывают по формуле, %,
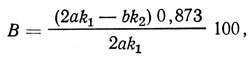
где 0,873 - средний поправочный коэффициент при использовании в качестве индикатора розоловой кислоты (вместо фенолфталеина).
Если качественной реакцией не обнаружено присутствие аммонийных солей в испытуемом растворе, определение основности следует производить, как указано выше.
Расчеты по изменению (повышению или понижению) основности растворов хромовых дубителей приведены в "Справочнике кожевника. (Технология)".
© FURLIB.RU, 2013-2018
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"