
7.8.8. Определение содержания азота
Сточные воды кожевенных заводов содержат значительное количество соединений азота, в том числе нитраты, нитриты, аммонийные соли и органические вещества. В материальных балансах водоемов и очистных сооружений учитываются соотношения между содержанием различных соединений азота. За основную величину в этих расчетах принимается oсуммарное содержание всех присутствующих соединений азота ("общий азот"), выраженное в миллиграммах азота на 1 л сточной воды.
Если "общий азот" не может быть определен в день отбора пробы воды, то ее консервируют добавлением 1 мл концентрированной серной кислоты или 2 - 4 мл хлороформа на 1 л воды.
Суммарное содержание азота органических веществ и аммонийного азота определяют по методу Кьельдаля: к пробе воды добавляют концентрированную серную кислоту, сульфат калия, катализатор и нагревают до разложения органических соединений. Образовавшиеся и имеющиеся в воде аммонийные соли отгоняют с паром в виде аммиака.
Содержание общего азота, мг/л,
X = Х1 + Х4 + Х5,
где X1 - содержание органического и аммонийного азота, мг/л; Х4 - содержание азота нитритов, мг/л; Х5 - содержание азота нитратов, мг/л.
Нитраты и нитриты при обработке воды по методу Кьельдаля разлагаются с выделением летучих окислов азота. Нитраты и нитриты определяют отдельно и, пересчитав полученные данные на азот, прибавляют к результату, полученному методом Кьельдаля.
Определение содержания органического и аммонийного азота. 25 - 100 мл отстоявшейся сточной воды помещают в колбу Кьельдаля, прибавляют 10 мл концентрированной серной кислоты, около 0,5 г сульфата меди или 0,1 г селена, 0,5 г сульфата калия и кипятят содержимое колбы под тягой до тех пор, пока раствор в колбе не станет совсем прозрачным, бесцветным или слегка зеленоватого оттенка.
Содержимое колбы после охлаждения осторожно разбавляют водой (до 150 - 200 мл) и переносят в колбу для отгонки. В колбу добавляют несколько капель раствора фенолфталеина и добавляют 50 %-ный раствор гидроксида натрия или гидроксида калия до появления розовой окраски. Колбу соединяют с холодильником, нижний конец которого опущен в приемную колбу с 50 мл 2 %-ного раствора борной кислоты. Анализируемую жидкость перемешивают и кипятят до тех пор, пока в приемной колбе не соберется около 200 мл отгона. Тогда холодильник приподнимают, чтобы его нижний конец не касался раствора, и продолжают перегонку еще 5 - 6 мин.
По окончании отгонки содержимое колбы титруют 0,1 н. раствором соляной или серной кислоты с индикатором бромфеноловым синим или метиловым красным до изменения окраски.
Параллельно проводят глухой опыт в тех же условиях без сточной воды.
Суммарное содержание органического и аммонийного азота, мг/л,
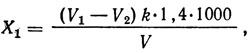
где V1 и V2 - объемы 0,1 н. раствора соляной или серной кислоты, израсходованные на титрование пробы и в глухом опыте, мл; k - поправочный коэффициент для приведения концентрации раствора соляной или серной кислоты к точно 0,1 н.; 1,4 - количество азота, соответствующее 1 мл 0,1 н. кислоты, мг; V - объем сточной воды, взятый для анализа, мл.
Содержание органического азота, мг/л,
Х2 = Х1 - Х3,
где Х3 - содержание аммонийного азота, мг/л.
Определение содержания аммонийного азота. В сточные воды кожевенных заводов соединения аммония попадают в результате применения в производственных процессах сульфата аммония, а аммиак - в результате разложения белковых веществ в процессе золения и мягчения.
Аммонийный азот определяют титриметрическим методом после отгонки аммиака, поглощения его борной кислотой с последующим титрованием 0,1 н. раствором соляной или серной кислоты.
Определению мешает свободный хлор. Его устраняют перед перегонкой прибавлением тиосульфата натрия (для удаления 0,5 мг хлора достаточно прибавить 1 мл 0,01 н. раствора тиосульфата натрия). Определению мешают сульфид-ионы, которые можно устранить, добавив, немного карбоната свинца.
Отгонку аммиака проводят в щелочной среде, однако если в воде содержатся белковые вещества (это имеет место в сточных водах кожевенных заводов) применение сильной щелочи недопустимо. Тогда анализируемую сточную воду приводят к рН 7,4, прибавляя фосфатный буферный раствор.
Приготовление фосфатного буферного раствора рН 7,4: 14,3 г однозамещенного фосфата калия KH2PO4 и 68,8 г двузамещенного фосфата калия K2HPO4 растворяют в дистиллированной воде и доводят объем раствора до 1 л.
Приготовление раствора индикатора: 0,1 г метилового красного растворяют в 7,4 мл 0,05 н. раствора гидроксида натрия и разбавляют раствор до 100 мл дистиллированной водой или 0,1 г бромфенолового синего растворяют в 3,0 мл 0,05 н. раствора гидроксида натрия и разбавляют раствор дистиллированной водой до 100 мл.
Для определения содержания аммонийного азота в колбу для перегонки помещают 50 - 100 мл сточной воды и нейтрализуют до рН 7 (необходимое для нейтрализации количество кислоты или щелочи находят титрованием другой порции сточной воды), приливают 40 мл фосфатного буферного раствора, разбавляют дистиллированной водой до объема около 400 мл и отгоняют аммиак (см. выше). Аналогично выполняют титрование.
Параллельно проводят глухой опыт в тех же условиях и с теми же реактивами, но без сточной воды.
Содержание аммонийного азота рассчитывают так же, как содержание органического и аммонийного азота.
Определение содержания азота нитритов. Нитриты являются промежуточным продуктом биохимического окисления аммиака или восстановления нитратов. В большом количестве нитриты находятся в некоторых промышленных и биологически очищенных сточных водах.
Вследствие нестойкости нитритов их следует определять сразу после отбора пробы.
Качественное определение: к 10 мл пробы прибавляют 1 мл раствора сульфаниловой кислоты и 1 мл раствора α-нафтиламина или 1 мл реактива Грисса. В присутствии нитритов появляется розовая или красно-фиолетовая окраска.
Количественное определение содержания нитритов проводят колориметрическим методом с применением реактива Грисса. Метод основан на превращении сульфаниловой кислоты, содержащейся в реактиве Грисса, под действием нитрит-ионов в кислой среде в диазосоединение и на реакции последнего с α-нафтиламином с образованием красно-фиолетового азокрасителя. Интенсивность окраски раствора пропорциональна концентрации нитритов.
Протекание реакции в значительной степени зависит от рН среды.
Определению мешают взвешенные вещества и мутность воды, поэтому перед анализом пробу воды фильтруют через бумажный фильтр. Первые порции фильтрата отбрасывают. Если мутность не устраняется фильтрованием, пробу осветляют коагулированием коллоидных частиц гидроксидом алюминия. Для этого к 100 мл сточной воды прибавляют 2 г гидроксида алюминия, тщательно перемешивают, оставляют на 5 мин и фильтруют, отбрасывая первые порции фильтрата.
Приготовление 1%-ного реактива Грисса: 1 г реактива Грисса растирают в ступке до однородной массы и растворяют в 100 мл 12%-ной уксусной кислоты. Если раствор имеет розовую окраску, в него добавляют небольшое количество цинковой пыли, перемешивают и фильтруют через хлопчатобумажную ткань, промытую водой. Для работы использут бесцветный отстоявшийся раствор.
Приготовление растворов сульфаниловой кислоты и α-нафтиламина (при отсутствии готового реактива Грисса): 0,6 г сульфаниловой кислоты растворяют в 75 мл горячей дистиллированной воды и доводят объем до 100 мл; 0,6 г α-нафтиламина растворяют в небольшом объеме дистиллированной воды, приливают 25 мл ледяной уксусной кислоты и доводят объем раствора до 100 мл дистиллированной водой. При образовании мути раствор фильтруют через хлопчатобумажную ткань, промытую дистиллированной водой. Раствор сохраняется 2 - 3 мес. Вместо α-нафтиламина можно использовать нафтилэтилендиамин.
Приготовление стандартного раствора нитрита натрия: 0,4972 г нитрита натрия NaNО2, высушенного при температуре 105°С, растворяют в дистиллированной воде и доводят объем раствора до 1 л дистиллированной водой. Раствор консервируют, добавляя 1 мл хлороформа, и сохраняют в холодном месте. Раствор устойчив в течение 1 мес. 1 мл этого раствора содержит 0,1 мг азота.
Приготовление рабочего раствора: 10 мл стандартного раствора помещают в мерную колбу вместимостью 1 л и доводят объем раствора до метки дистиллированной водой. 1 мл рабочего раствора содержит 0,001 мг азота. Рабочий раствор готовят в день построения калибровочного графика.
Приготовление дистиллированнной воды, не содержащей нитритов: к 1 мл дистиллированной воды приливают 1 мл концентрированной серной кислоты, 0,2 мл 50%-ного раствора сульфата марганца MnSО4.5H2О и 1 - 3 мл 0,04%-ного раствора перма нганата калия КМnO4. Жидкость должна стать розовой. Через 15 мин ее обесцвечивают, прибавляя по каплям 0,09%-ный раствор оксалата аммония. Для очистки воды от нитритов можно прилить к ней щелочной раствор перманганата калия и провести перегонку, отбрасывая первые 50 мл дистиллята.
Построение калибровочного графика: в 12 мерных колб вместимостью 50 мл вносят 0; 0,5; 1; 2; 3;...; 9 и 10 мл рабочего раствора нитрита натрия и доводят объем растворов в колбах до метки дистиллированной водой. В каждую колбу прибавляют 2 мл раствора реактива Грисса и перемешивают. При отсутствии реактива Грисса в каждую колбу прибавляют по 1 мл раствора сульфанилозой кислоты и тщательно перемешивают. Через 3 - 10 мин приливают по 1 мл раствора α-нафтиламина, 1 мл 2 М раствора ацетата натрия, снова перемешивают.
Через 30 мин определяют оптическую плотность растворов на фотоколориметре с зеленым светофильтром (λ = 520 нм) при толщине поглощающего слоя 5 см. В качестве раствора сравнения используют пробу, содержащую все реактивы, кроме рабочего раствора.
По результатам определения строят калибровочный график зависимости оптической плотности растворов от содержания азота нитритов.
Для определения содержания азота нитритов в мерную колбу вместимостью 50 мл помещают 50 мл профильтрованной сточной воды, нейтрализованной до рН 7. К пробе прибавляют 2 мл раствора реактива Грисса или сульфаниловой кислоты и α-нафтиламина, перемешивают. Через 30 мин определяют оптическую плотность раствора. В качестве раствора для сравнения используют дистиллированную воду с реактивом Грисса.
Если проба сточной воды окрашена, то определяют ее оптическую плотность без добавления реактива Грисса и вычитают результат из оптической пробы анализируемого раствора. Для ускорения реакции раствор после добавления реактива Грисса можно нагреть на водяной бане при температуре 60°С в течение 3 - 5 мин и через 10 мин провести определение оптической плотности.
По калибровочному графику находят содержание нитритного азота, соответствующее установленной оптической плотности.
Содержание азота нитритов, мг N/л,
Х4= с · 50/V,
где с - содержание азота нитритов, найденное по калибровочному графику, мг/л; 50 - объем, до которого разбавлена проба, взятая для колориметрирования, мл; V - объем сточной воды, взятый для анализа, мл.
При большом содержании нитритов вместо пурпурной окраски раствора получается желтая; в этом случае необходимо разбавить пробу и повторить определение.
Определение содержания азота нитратов. Нитраты встречаются почти во всех видах сточных вод, их количество колеблется от следов до нескольких мг/л. При концентрациях NO-3-ионов 0,1 - 20 мг/л хорошие результаты дает фотоколориметрический метод с применением салицилата натрия.
Определение основано на реакции нитрат-ионов с салицилатом натрия в среде серной кислоты; образуется смесь 3-нитросалициловой и 5-нитросалициловой кислот, соли которых в щелочной среде имеют желтую окраску. Интенсивность окраски пропорциональна содержанию нитрат-ионов в пробе.
Определению мешают окрашенные органические вещества, хлориды в количестве более 200 мг/л, железо в количестве более 5 мг/л, нитриты в количестве более 2 мг/л.
Окрашенные органические вещества удаляют, добавляя на каждые 100 мл воды по 2 г гидроксида алюминия. Образующуюся суспензию хорошо перемешивают, оставляют на несколько минут, затем фильтруют, отбрасывая первую порцию фильтрата. При этой обработке удаляется также железо и другие тяжелые металлы. Если обработку гидроксидом алюминия не проводили, то железо устраняют прибавлением нескольких кристаллов сегнетовой соли. Хлориды удаляют обработкой пробы раствором сульфата серебра (4,4 г на 1 л дистиллированной воды). Образовавшийся осадок хлорида серебра отфильтровывают. Чувствительность метода высока, поэтому допускается устранение действия хлоридов разбавлением пробы до концентрации хлоридов менее 200 мг/л. Действие нитритов устраняют путем выпаривания досуха на водяной бане пробы сточной воды с добавлением на каждые 20 мл- воды 0,05 г сульфата аммония.
Приготовление стандартного раствора нитрата калия: 0,7216 г KNО3, предварительно высушенного при температуре 105°С, растворяют в дистиллированной воде, прибавляют 1 мл хлороформа и разбавляют водой до 1 л. 1 мл стандартного раствора содержит 0,1 мг азота нитратов.
Приготовление рабочего раствора нитрата калия: 10 мл стандартного раствора разбавляют до 100 мл дистиллированной водой. 1 мл рабочего раствора содержит 0,01 мг азота нитратов. Для построения калибровочного графика применяют только свежеприготовленный раствор.
Построение калибровочного графика. В 10 мерных чашек помещают 0; 0,5; 1,0; 2,0;...; 7,0; 8,0 мл рабочего раствора, что соответствует содержанию азота от 0 до 1,6 мг/л, прибавляют по 1 мл; 10%-ного спиртового раствора салициловой кислоты и выпаривают на водяной бане досуха. После охлаждения к сухому остатку приливают 1 мл концентрированной серной кислоты и оставляют на 5 мин. Затем осторожно приливают 15 мл дистиллированной воды, которой омывают стенки чашки. К раствору приливают 6 мл 30%-ного раствора гидроксида натрия. Растворы приобретают желтую окраску, интенсивность которой пропорциональна содержанию нитратов.
Содержимое каждой чашки переносят в мерные колбы вместимостью 50 мл, чашки ополаскивают порциями дистиллированной воды, которую также сливают в мерные колбы. Объем растворов в колбах доводят до метки дистиллированной водой и через 5 мин определяют оптическую плотность растворов на фотоэлектроколориметре с фиолетовым светофильтром (λ = 410 нм) в кюветах с толщиной поглощающего слоя 10 мм. По результатам строят калибровочный график зависимости оптической плотности от содержания азота нитратов.
Для определения содержания азота нитратов в сточной воде 10 мл отстоявшейся пробы или 10 мл фильтрата после удаления препятствующих определению примесей помещают в фарфоровую чашку, прибавляют 1 мл 10%-ного спиртового раствора салициловой кислоты и далее проводят все операции, как описано при построении калибровочного графика.
Параллельно проводят глухой опыт, в котором вместо пробы сточной воды берут 10 мл дистиллированной воды. Эту пробу используют в качестве раствора сравнения при определении оптической плотности анализируемой пробы воды.
По калибровочному графику находят содержание азота нитратов,, соответствующее установленной оптической плотности.
Содержание азота нитратов, мг N/л,
Х5 = с · 50/V,
где с - содержание азота нитратов, найденное по калибровочному графику, мг/л; 50 - объем, до которого разбавлена проба, мл; V - объем сточной воды, взятый для анализа, мл.
© FURLIB.RU, 2013-2018
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"