
7.4.2. Определение активности протосубтилина Г-3х
Протеолитическую активность (способность) протосубтилина Г-3х определяют модифицированным методом Ансона.
Определение протеолитической активности основано на гидролизе казеината натрия препаратом фермента, который находится в исследуемом растворе, с последующей инактивацией фермента осаждением непрогидролизованного белка трихлоруксусной кислотой и определением количества продуктов гидролиза казеината натрия колориметрическим методом с применением реактива Фолина.
Протеолитическая активность характеризует способность ферментов катализировать расщепление белка до полипептидов и аминокислот и выражается числом единиц протеазы в 1 г препарата.
За единицу протеолитической активности принимают такое количество фермента, которое за 1 мин при температуре 30°С превращает в неосаждаемое трихлоруксусной кислотой состояние казеинат натрия в количестве, соответствующем 1 мкмоль тирозина (1 мкмоль тирозина равен 0,181 мг). Активность выражается в единицах на 1 г (ед./г).
Приготовление 0,1 М универсального буферного раствора. Сначала приготовляют растворы А, В, С, D.
Приготовление раствора А - 0,1М раствора, уксусной кислоты: 5,7 мл ледяной уксусной кислоты растворяют в дистиллированной воде и доводят объем до 1 л.
Приготовление раствора В-0,1М раствора ортофосфорной кислоты: 6,45 г ортофосфорной кислоты растворяют в воде и доводят объем до 1 л.
Приготовление раствора С-0,1М раствора ортоборной кислоты: 6,18 г ортоборной кислоты растворяют в дистиллированной воде и доводят объем до 1 л.
Приготовление раствора D-1 н. раствора гидроксида натрия: 40 г гидроксида натрия растворяют в дистиллированной воде и доводят объем до 1 л.
Приготовление 0,1М буферного раствора: при смешении равных объемов растворов А, В, С получается буферная смесь с рН 1,8. Добавляя к этой смеси различные количества раствора D, получают буферные растворы с рН от 1,8 до 12,0. Для нейтральных протеаз рН буферной смеси должен быть равен 7,2 ± 0,2.
Приготовление 0,3М раствора трихлоруксусной кислоты. 50 г трихлоруксусной кислоты растворяют в дистиллированной воде, доводят объем раствора до 1 л и затем фильтруют.
Приготовление реактива Фолина (основной раствор). 100 г вольфрамата натрия и 25 г молибдата натрия вносят в круглодонную колбу вместимостью 2000 мл с пришлифованным обратным холодильником, добавляют 700 мл воды, 500 мл 85%-ной ортофосфорной кислоты плотностью 1,689 г/см3 и 100 мл концентрированной соляной кислоты. Смесь кипятят на слабом огне на асбестовой сетке или на плитке с закрытой спиралью в течение 10 ч (нагревание можно прерывать). Затем содержимое колбы охлаждают, переносят в коническую колбу. Стенки круглодонной колбы и холодильника ополаскивают 50 мл дистиллированной воды и сливают ее в коническую колбу. Туда же добавляют 150 г сульфата лития и 5 капель брома.
Открытую колбу нагревают и кипятят под тягой на слабом огне в течение 15 - 20 мин, чтобы удалить пары брома. Раствор должен иметь желтую окраску. Если раствор зеленый, то обработку бромом проводят вторично. Затем раствор охлаждают, переносят в мерную колбу вместимостью 1 л, доливают дистиллированную воду до метки и перемешивают. Раствор фильтруют через стекловату. Кислотность реактива Фолина проверяют титрованием разбавленного в 10 раз реактива 0,1 н. раствором гидроксида натрия по фенолфталеину.
Кислотность реактива Фолина должна быть 2 н., если она больше, то реактив разбавляют дистиллированной водой, если меньше - реактив для работы непригоден.
Приготовленный раствор хранят в посуде из темного стекла в холодильнике. Через 2 - 3 мес. хранения следует добавить в раствор 1 - 2 капли брома и снова прокипятить.
Рабочий раствор Фолина готовят разведением основного раствора дистиллированной водой в соотношении 1 : 2.
Приготовление раствора протосубтилина Г-3х. 0,1 - 1,0 г исследуемого препарата тщательно растирают в стаканчике стеклянной палочкой с небольшим количеством 0,1М универсального буферного раствора с рН 7,2. Затем переносят в мерную колбу вместимостью 100 мл и доводят объем до метки этим же буферным раствором. Последующие разведения ферментного раствора производят также 0,1М универсальным буферным раствором с рН 7,2.
Приготовление 2%-ного раствора казеината натрия (субстрата). 2 г воздушно-сухого казеината натрия растворяют в 90 мл 0,1М универсального буферного раствора с рН 7,2. Если рН полученного раствора ниже 7,2, то добавляют по каплям 1 н. раствор гидроксида натрия до получения рН 7,2. Раствор переносят в мерную колбу вместимостью 100 мл и добавляют до метки буферный раствор с рН 7,2.
Навеску казеината натрия предварительно растирают в ступке с небольшим количеством буферного раствора или перемешивают на магнитной мешалке.
Срок хранения в холодильнике 2%-ного раствора казеината натрия не более 1 сут.
Ферментативный гидролиз. Его ведут в течение 10 мин при температуре 30°С. Перед проведением гидролиза раствор фермента и казеината натрия термостатируют. Для прекращения гидролиза и осаждения непрогидролизованной части казеината натрия прибавляют 0,3М раствор трихлоруксусной кислоты, равный объему реакционной смеси, встряхивают, выдерживают в течение 20 мин при температуре 30°С и фильтруют.
При колориметрировании в кювете с толщиной поглощающего слоя 10 мм оптическая плотность должна находиться в области 0,2 - 0,6. Однако в некоторых случаях рабочая область оптической плотности может иметь другие значения, что зависит от вида и степени очистки исследуемого ферментного препарата.
По 2 мл субстрата вливают в две пробирки и помещают в ультратермостат при температуре 30°С. Примерно через 10 мин в каждую пробирку приливают по 2 мл раствора фермента, пробирки встряхивают и оставляют на гидролиз ровно на 10 мин при температуре 30°С. Через 10 мин добавляют в обе пробирки по 4 мл 0,3М трихлоруксусной кислоты, чтобы прервать ферментативную реакцию и осадить белок и высокомолекулярные продукты гидролиза. Быстро перемешивают смесь и для обеспечения полного осаждения выдерживают пробирки со смесью при температуре 30°С еще 20 мин. Затем смесь фильтруют через маленькие воронки с бумажными фильтрами в сухие пробирки. Фильтрат должен быть совершенно прозрачным. В пробирки отбирают по 1 мл фильтрата, добавляют по 5 мл 0,5М раствора карбоната натрия, перемешивают и быстро при непрерывном перемешивании приливают по 1 мл рабочего раствора реактива Фолина. Дают реакционной смеси постоять 20 мин. После реакции растворы приобретают голубую окраску, интенсивность которой определяют на фотоэлектроколориметре против контрольной пробы.
Контрольную пробу готовят, прибавляя реактивы в обратной последовательности: к 2 мл ферментного раствора того же разведения, как и в опыте, добавляют 4 мл трихлоруксусной кислоты, выдерживают в ультратермостате при температуре 30°С 10 мин, а затем вносят 2 мл субстрата. Через 20 мин нахождения в термостате раствор фильтруют, отбирают в сухую пробирку 1 мл фильтрата, при перемешивании вносят 5 мл 0,5М карбоната натрия и 1 мл рабочего раствора реактива Фолина. Колориметрирование производят на фотоэлектроколориметре при длине волны 656 - 670 нм в кюветах с толщиной поглощающего свет слоя 10 мм.
Для расчета протеолитической активности необходимо построить градуировочный график по тирозину. Затем по градуировочному графику вычислить тирозиновый эквивалент, т. е. ту оптическую плотность, которую дал бы 1 мкмоль тирозина в 1 мл стандартного раствора. Этот эквивалент необходимо устанавливать для каждой новой партии реактива Фолина и для каждого фотоэлектроколориметра.
Для построения градуировочного графика готовят раствор тирозина концентрации 0,001 М. Для этого 181,19 мг чистого тирозина растворяют в 0,2 н. растворе соляной кислоты в мерной колбе вместимостью 1 л. Из этого исходного раствора тирозина готовят дальнейшим разведением следующие растворы.
Раствор 1: в мерную колбу вместимостью 50 мл вносят 1 мл исходного раствора тирозина и доводят объем до метки 0,2 н. раствором соляной кислоты. Концентрация тирозина С1 при этом составляет 0,2х10-4 М, или 0,02 мкмоль/мл.
Другие растворы готовят так же:
раствор 2 - 2 мл исходного раствора; С2 - 0,04 · 10-4М, или 0,04 мкмоль/мл;
раствор 3 - 4 мл исходного раствора; С3 - 0,8 · 10-4М, или 0,08 мкмоль/мл;
раствор 4 - 5 мл исходного раствора; С4 - 1,0 · 10-4М, или 0,10 мкмоль/мл;
раствор 5 - 7,5 мл исходного раствора; С5 - 1,5 · 10-4М, или 0,15 мкмоль/мл;
раствор 6 - 10 мл исходного раствора; С6 - 2,0 · 10-4М, или 0,20 мкмоль/мл;
раствор 7 - 15 мл исходного раствора; С7 - 3,0 · 10-4М, или 0,30 мкмоль/мл.
Затем в пробирки вносят по 1 мл раствора тирозина разной концентрации. Добавляют в них при постоянном помешивании по 5 мл 0,5 М раствора карбоната натрия и по 1 мл рабочего раствора реактива Фолина.
Контрольный опыт готовят так же, но вместо раствора тирозина берут 1 мл дистиллированной воды. Дают реакционной жидкости постоять 20 мин. Интенсивность окраски измеряется из фотоэлектроколориметре против контрольной пробы при длине волны 656 - 670 нм в кюветах с толщиной поглощающего свет слоя 10 мм. Следует приготовить растворы из двух навесок тирозина и провести описанным выше способом два параллельных опыта.
По средним данным, полученным из двух опытов, строится градуировочный график (рис. 1).
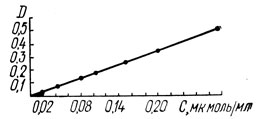
Рис. 1. Градуировочный график зависимости оптической плотности D от концентрации тирозина С
По градуировочному графику определяют оптическую плотность, соответствующую содержанию тирозина 0,1 мкмоль/мл. Умножив эту величину на 10, получают тирозиновый эквивалент, т. е. оптическую плотность, соответствующую содержанию тирозина 1 мкмоль/мл. На градуировочном графике, представленном на рис. 1, содержанию тирозина 0,1 мкмоль/мл соответствует оптическая плотность 0,151. Тирозиновый эквивалент в данном случае равен 1,51.
Протеолитическая активность (ПА) протосубтилина Г-3х, ед./г;
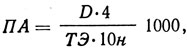
где D - оптическая плотность анализируемого раствора фермента; 4 - коэффициент разбавления раствора фермента при определении оптической плотности; ТЭ - тирозиновый эквивалент; 10 - продолжительность гидролиза в мин; н - количество фермента, взятое на протеолиз, мг/мл; 1000 - коэффициент пересчета мг в г.
© FURLIB.RU, 2013-2018
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"
При копировании материалов просим ставить активную ссылку на страницу источник:
http://furlib.ru/ "FurLib.ru: Обработка кожи и меха"